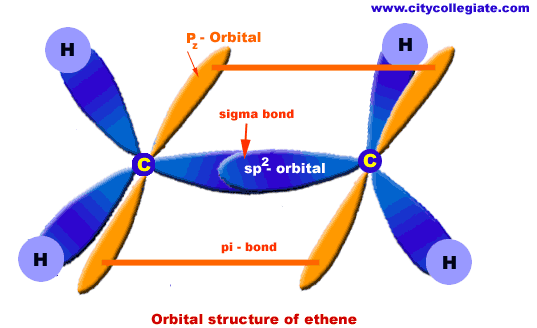
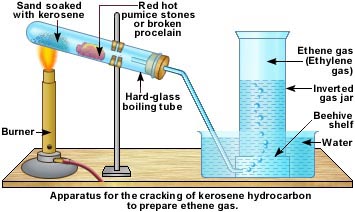
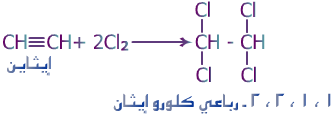
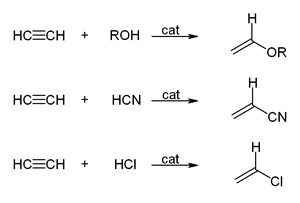
الهيدروكربونات الأليفاتية تنقسم إلى ثلاث مجموعات, السلاسل المتجانسة طبقا لحالة تشبعها: البارافينات (الألكانات) والتي لا يكون فيها أي روابط ثنائية أو ثلاثية, الأولفينات (الألكينات) والتي تحتوى على روابط ثنائية, والتي يمكن أن تكون أولفين أحادى يحتوى على رابطة ثنائية واحدة, أولفين ثنائي ويحتوى على رابطتين, أولفين متعدد ويحتوى على عدة روابط ثنائية. المجموعة الثالثة هي الألكايينات. كما توجد تقسيمات آخر للمركبات الأليفاتية اعتمادا على المجموعات الفعالة الموجودة بها.
كما أن المركبات الأليفاتية يمكن أن ينظر لها عن طريق استقامة أو تفرع السلسلة المكونة للمركب, ودرجة التفرع أيضا لأن هذا يؤثر على خواصها, مثل رقم الأوكتان في صناعة البترول.
الألكانات: هي مركبات هيدروكربونية أليفاتية مشبعة، وتُعد هذه المركبات أقل المركبات الهيدروكربونية نشاطاً في الظروف العادية، ولذلك سميت قديماً البارافينات (أي قليلة الميل للتفاعل). تسمية الألكانات: تسمى المركبات العضوية حسب نظامين، التسمية الشائعة والتي قد تختلف من مكان إلى آخر، وتسمية دولية محددة تبعاً لنظام الإيوباك والتي تعتمد على اسم الألكان. والألكانات قد تكون غير متفرعة كما مر معنا أو متفرعة أي تحتوي على مجموعات جانبية كما في الصيغتين التاليتين: قواعد تسمية الألكانات حسب الأيوباك 1 ـ نحدد أطول سلسلة متصلة من ذرات الكربون. 2 ـ نرقم ذرات الكربون في هذه السلسلة من أحد طرفيها إلي الطرف الآخر بحيث تأخذ ذرة الكربون المتصلة بالمجموعة الجانبية أصغر رقم. 3 ـ نحدد المجموعة أو المجموعات من حيث موقع إتصالها بالسلسلة. 4 ـ نكتب الرقم الدال على موقع اتصال المجموعة الجانبية بالسلسلة ثم اسم المجموعة، ويتم الفصل بين الرقم والاسم بخط قصير. 5 ـ في حالة وجود أكثر من مجموعة جانبية مثل ميثيل (- CH3) وإيثيل (- C2H5) فإن أولوية كتابة المجموعة برقمها تتم طبقاً للترتيب الأبجدي أي إيثيل قبل ميثيل. 6 ـ عند اتصال مجموعتين متماثلتين مثل مجموعتي ميثيل (- CH3) بنفس ذرة الكربون في السلسلة، فنستخدم كلمة ثنائي ونضع قبلها نفس رقم ذرة الكربون مرتين. هذه الألكانات العشرة المكتوبة باللون الأحمر لسهولة الحفظ ميثان وإيثان بنات عم تزوجهم رجل يدعى بروبان وأسكنهم في بيوتان ورزق منهما بنتان
أسماهما هكسان وهبتان
ثم تقدم لهما رجلينهما أوكتان ونونان
وكان مهرهما ديكان .
د ربيع
sgsgm lphqvhj tn hg;dldhx hguq,dm H ] vfdu Hf, hgodv


 LinkBack URL
LinkBack URL About LinkBacks
About LinkBacks


 رد مع اقتباس
رد مع اقتباس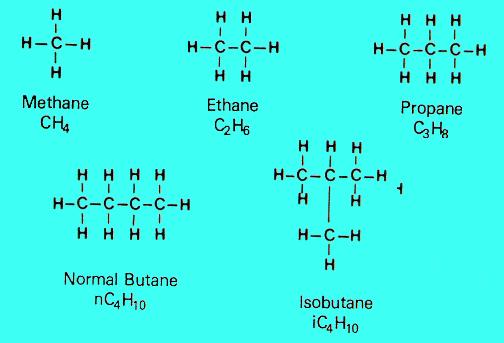













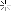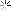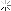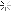

المفضلات