كما يمكن الحصول على البنزألدهيد صناعيا انطلاقا من التولوين ، حيث تجرى كلورة التلوين لنحصل على كلوريد البنزيل C6H5-CH2Cl ، و عند استمرار الكلورة مع التسخين مع الماء وكمية قليلة من هيدروكسيد الكالسيوم أو حمض الكبريتيك يتكون البنزألدهيد
ويمكن الحصول على البنزألدهيد بطريقة أخرى و ذلك بالأكسدة المباشرة للتولوين بوجود عامل مساعد و درجة حرارة مرتفعة.
أما عند وجود عوامل مساعدة معينة مثل كلوريد الألمنيوم و كلوريد النحاس، فإن تفاعل كلوريد الفورميك مع التولوين يكون كما يلي:
وكما يتأكسد البنزألدهيد بواسطة أكسجين الهواء بسرعة كبيرة مكونا حمض البنزويك كما في التفاعل التالي :
ثم يؤكسد هيدروبيروكسيد –البنزويل الجزء الباقي من البنزألدهيد مكونا حمض البنزويك كما في التفاعل التالي :
و كذلك هناك تفاعلات مع البنزألدهيد و الأسيتون، حيث عند وجود الصودا الكاوية يتكاثف البنزألدهيد مع الأسيتون ، مشكلا بنزيليدين أستون أو ثنائي – بنزيلدين أسيتون، و هذا حسب الكميات المأخوذة من المادتين كما في التفاعل التالي:
أما في حالة الكيتونات الأروماتية
فإنها يمكن أن تتصل بمجموعة الكربونيل
مثل:
* مثيل – فنيل- كيتون ( أسيتوفينون) C6H5 COCH3
* ثنائي - فينيل كيتون ( بنزوفينون ) C6H5 CO C6H5
ويمكن الحصول على الكيتون الأروماتي وفق المعادلة الكيميائية التالية :
تسمية الألدهيدات و الكيتونات
لقد عرفت قواعد تسمية الكثير من المركبات العضوية، و أن هناك قواد متبعة لتسمية المركبات الكيميائية، كما أن هناك قواعد عامة تنطبق في كل الحالات على تسمية المركبات الكيميائية، كاختيار أطول سلسلة خطية متصلة من ذرات الكربون، وترقيم ذرات هذه السلسلة، وتحديد مواقع المستبدلات سواء أكانت مجموعات ألكيلية فرعية، أو عناصر، أو مجموعات وظيفية أو غيرها. فعندما نأخذ مثلا المركبات الكيميائية التالية ، و نريد تسميتها نجد أن:
CH3CH2CH2CH3
في هذا المركب الكيميائي نلاحظ أنه يتكون من هيدروجين وكربون ، و ذلك يتكون من روابط بسيطة كلها ، فلذلك ينتمي إلى مجموعة الألكانات، و له أربعة ذرات كربون، فتسميته تخضع لتسمية الألكانات أي المركب الكيميائي السابق يمثل البوتان.
CH3CH = CHCH3
في هذا المركب الكيميائي، نلاحظ أنه من عائلة الالكنات أي من مجموعة الكربوهيدرات ذات رابطة ثنائية واحدة ، فلذلك يكون إسمه هو البوتن - 2
CH3CHOHCH2CH3
في هذا المركب الكيميائي نجد أنه من المركبات الكربوهيدرتية الهيدروجينية، و كذلك يحوي الوظيفة الكحولية في ذرة الكربون الثانية، فبذلك يكون إسم هذا المركب هو البوتانول -2
CH2OHCH2CH2CH3
كذلك تسمية هذا المركب يخضع لمجموع الكحولات ، و إسمه الروبانول – 1
من الأمثلة السابقة نجد أن المركبات الكيميائية لها أربعة ذرات كربون كلها ،و لكنها تختلف في الوظائف و المجموعات، مما أدى إلى اختلاف أسمائها حسب بعض القواعد المتخذة عالميا .
1 - تسمية الألدهيدات في IUPAC
لنأخذ مجموعة من المركبات الكيميائية كما في الجدول التالي، وتكون تسميتها معروفة
من الجدول السابق سمينا المركبات حسب الوظيفة و المجموعة، و إذا حولت المركبات السابقة في الجدول إلى مركبات ألدهيدية ، أي تحوي الوظيفة الألدهيدية تتحول أسماء هذه المركبات إلى:
حسب قواعد الاتحاد الدولي IUPAC فإن حرف (آن) في اسم الفحم الهيدروجيني يحذف ويستعاض عنه بالنهاية (al) (ال) للدلالة على الألديهيد وسبب حذف حرف (e) هو حتى لا يلتقي مع حرف العلة الآخر (a).
وهكذا يكون اسم المركب:
CH3(CH2)5-CHO هو Heptanal هبتانال.
والمركب CH3(CH2)8-CHO هو Decanal ديكانال.
2 – تسمية الكيتونات في IUPA
1- تطبق القواعد المعمول بها من حيث طول السلسلة وترقيم ذرات الكربون فيها وإعطاء مجموعة الكربونيل أفضلية في الترقيم أي إعطاءها أصغر رقم ممكن،
أمثلة:
أ ) فحم هيدروجيني مشبع CH3CH2CH3 Propane بروبان
ألدهيد CHO2 CH3 Propanal CH بروبانال.
كيتون CH3COCH3 Propanone بروبانون.

 ب) إذا احتوى المركب على مجموعة كيتونية ومجموعات أخرى كالمجموعة الألدهيدية والحمضية فإنه يعتبر مستبدلاً ويأخذ مقطعاً متقدماً هو oxo ـ أو keto ـ أما إذا وجد في المركب كحولاً فيعتبر الكحول هو المستبدل ويحتفظ الكيتون بأفضلية 3 - الأسماء الشائعة للكيتونات و الألدهيدات الكثير من الألديهيدات و الكيتونات ومشتقاتهما لهما أسماء شائعة معروفة أهمها : HCHO * فورما لين أو فورم ألدهيد . كثير الاستخدام Formaldéhyde أو Formalin والاسم حسب IUPAC هو Méthanal ميثانال هو قليل الاستخدام. CH3CHO * أسيت ألدهايد acétaldéhyde وحسب IUPAC. إيثانال Ethanal PropionaldehydeCH3CH2CHO * هذا الاسم شائع تجارياً أما الاسم حسب IUPAC فهو بروبانال CHOCH2CH2CHO* الاسم الشائع Succinaldehyde أما الاسم حسب IUPAC فهو الأكثر استخداماً وهو Butadiène. أما الأسماء الشائعة للكيتونات فهنالك الكثير من المركبات البحتة وبعض المركبات المختلطة لها أسماء شائعة تستخدم وتعتبر مقبولة من الاتحاد الدولي ، و منها :
ب) إذا احتوى المركب على مجموعة كيتونية ومجموعات أخرى كالمجموعة الألدهيدية والحمضية فإنه يعتبر مستبدلاً ويأخذ مقطعاً متقدماً هو oxo ـ أو keto ـ أما إذا وجد في المركب كحولاً فيعتبر الكحول هو المستبدل ويحتفظ الكيتون بأفضلية 3 - الأسماء الشائعة للكيتونات و الألدهيدات الكثير من الألديهيدات و الكيتونات ومشتقاتهما لهما أسماء شائعة معروفة أهمها : HCHO * فورما لين أو فورم ألدهيد . كثير الاستخدام Formaldéhyde أو Formalin والاسم حسب IUPAC هو Méthanal ميثانال هو قليل الاستخدام. CH3CHO * أسيت ألدهايد acétaldéhyde وحسب IUPAC. إيثانال Ethanal PropionaldehydeCH3CH2CHO * هذا الاسم شائع تجارياً أما الاسم حسب IUPAC فهو بروبانال CHOCH2CH2CHO* الاسم الشائع Succinaldehyde أما الاسم حسب IUPAC فهو الأكثر استخداماً وهو Butadiène. أما الأسماء الشائعة للكيتونات فهنالك الكثير من المركبات البحتة وبعض المركبات المختلطة لها أسماء شائعة تستخدم وتعتبر مقبولة من الاتحاد الدولي ، و منها :
Acetophenone أسيتوفينون Methyl phenyl ketone ميثيل فينيل كيتون

Benzophenoneبنزوفينون Diphenyl ketone ثنائي فينيل كيتون
مع أرق تحياتى
أ د ربيع أبو الخير


 LinkBack URL
LinkBack URL About LinkBacks
About LinkBacks

 رد مع اقتباس
رد مع اقتباس

 المركبات الأروماتية :
المركبات الأروماتية : 

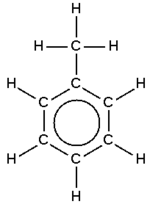
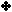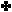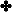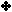 ويتم اختصار حلقة البنزين على شكل سداسي الأضلاع , كل زاوية من زوايا الشكل تمثل ذرة كربون مرتبطة بذرة هيدروجين.
ويتم اختصار حلقة البنزين على شكل سداسي الأضلاع , كل زاوية من زوايا الشكل تمثل ذرة كربون مرتبطة بذرة هيدروجين.



















المفضلات